La parodontite (déchaussement des dents) est considérée depuis plusieurs années comme un facteur de risque pour la démence et la maladie d’Alzheimer (1,2,3,4,5). On constate effectivement une relation étroite entre la parodontite et les déficiences cognitives chez l’humain.
On peut bien entendu se poser la question concernant cette association: est-ce la parodontite qui favorise la maladie d’Alzheimer ou ne serait-ce pas plutôt le patient atteint de déficience cognitives qui n’est plus capable de maintenir une hygiène correcte de sa cavité buccale favorisant ainsi le développement d’une parodontite?
On sait que la mastication et les gestes d’hygiène buccale provoquent le passage dans le sang de bactéries présentes dans la cavité buccale. Ces bactéries pouvant causer des affections « à distance » dans le corps humain. Ce passage de bactéries dans le sang augmente avec la sévérité de la maladie parodontale (6).
Dans une étude (7) de 2018, les chercheurs ont introduit des bactéries responsables de la parodontite (Porphyromonas gingivalis – Pg) dans la cavité buccale de 10 souris durant 22 semaines alors qu’un autre groupe de 10 souris recevaient un placebo. A la 23ème semaines, les souris étaient sacrifiées et on a recherché le présence de ces mêmes bactéries dans le cerveau ainsi que la présence de lésions typiques de la maladie d’Alzheimer.
Résultats: des bactéries parodontales (Pg) furent retrouvées dans les tissus cérébraux (microglie, astrocytes et neurones de l’hippocampe) des souris du groupe expérimental (E) mais pas dans le groupe contrôle (C, groupe placebo).
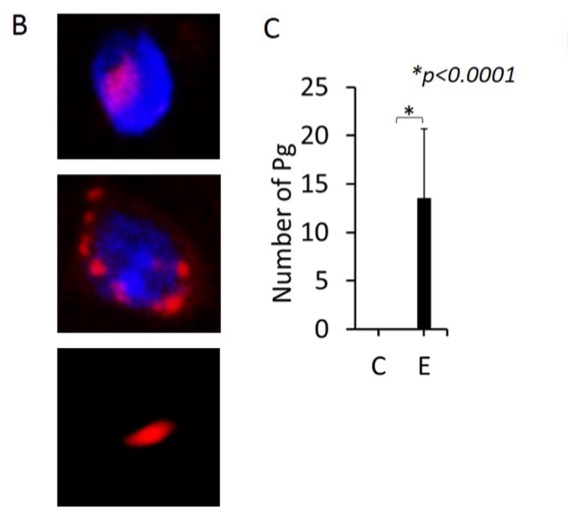
Figure B: en rouge Porphyromonas gingivalis intra-, péri-, et extra-cellulaires
Figure C: Nombre de bactéries par champs de 220X160 micromètres dans le groupe contrôle (C) et expérience (E)
De plus, tous les marqueurs de la maladie d’Alzheimer étaient augmentés dans le groupe test. Par exemple, la recherche de beta-amyloïde (petite protéine qui est caractéristique de la maladie d’Alzheimer) a été positive dans le groupe test mais négative dans le groupe placebo.
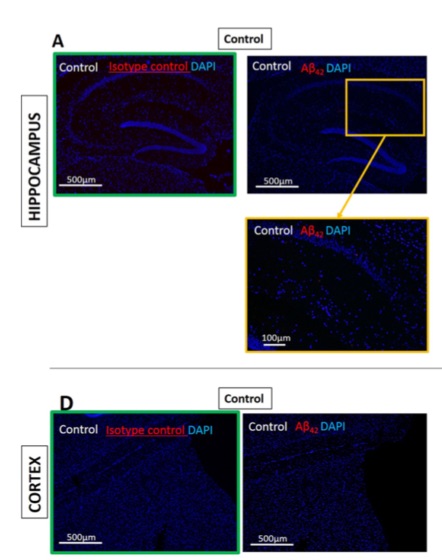
(Image de microscopie par immunofluorescence)
A et D. Pas de beta-amyloïde (en rouge) dans l’hippocampe et le cortex du groupe placebo
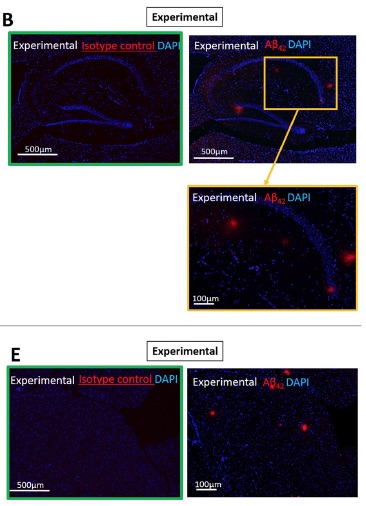
B et E. Présence de beta-amyloïde (en rouge) dans le groupe test (hippocampe et cortex)

C. et F. la différence entre le groupe C (placebo) et E (test) est statistiquement significative (p<0.00001)
Porphyromonas gingivalis est un des principaux responsables de la parodontite (déchaussement progressif des dents) mais on le retrouve également dans la cavité buccale de 25% des individus sains mais en quantité moindre (8).
Cette bactérie anaérobe a pour caractéristique de sécréter de la gingipaïne, une enzyme qui catalyse la destruction des protéines environnantes. On pense que c’est cette gingipaïne qui est responsable des dommages neuronaux constatés chez les malades.
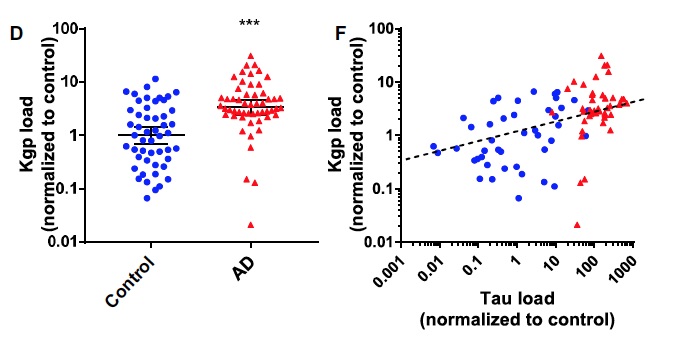
Une étude de 2019 (9) a trouvé des Porphyromonas gingivalis dans le cerveau et dans le liquide céphalo-rachidien de patients atteints de la maladie d’Alzheimer. La quantité de gingipaïne dans le cerveau était corrélée avec le diagnostic de maladie d’Alzheimer.
La quantité de protéine Tau (dans les neurones) est corrélée à l’avancée de la maladie d’Alzheimer. Or il existe un continuum entre la quantité de protéines Tau et la quantité de gingipaïne. Cela semble indiquer qu’il existe une forme infra-clinique de la maladie d’Alzheimer (càd sans symptôme – avec peu de protéine Tau) et que plus le taux de gingipaïne augment et plus la quantité de protéine Tau augmente, aboutissant à la forme clinique de la maladie, qui va peu à peu s’aggraver.
Une molécule testée dans cette étude (COR388) montre dans des cerveaux de souris infectées par P. Gingivalis, une réduction de la quantité de bactéries cérébrales et de la charge de beta-amyloïde.
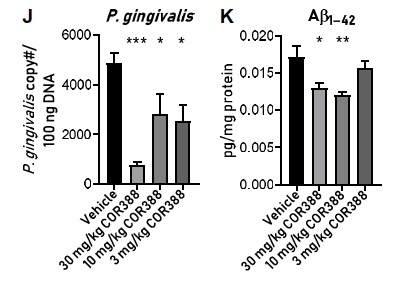
Vehicle est utilisé ci-dessus pour le médicament sans la substance active (placebo)
Il n’est pas établi que les symptômes cliniques de la maladie d’Alzheimer régressent avec la diminution de P. gingivalis et des plaques de beta-amyloïde dans le cerveau humain. Cependant, il existe maintenant des preuves solides qu’une parodontite non traitée va entraîner la présence de Porphyromonas gingivalis dans le sang puis dans le liquide céphalo-rachidien et le cerveau du patient. Les gingipaïnes produites par ces bactéries entraînant la destruction de cellules cérébrales ainsi que, en réaction, l’accumulation de beta-amyloïde et de protéines Tau anormales.
Une étude de 2016 (4) a enrôlé 60 participants atteints de démence légère à modérée. Age moyen 77.7 ans, 51% d’homme. Deux tests ont été pratiqués sur chaque participant (Alzheimer’s Disease Assessment Scale et standardized Mini-Mental State Examination) pour obtenir un score de leurs fonctions cognitives. Les patients ont ensuite été évalués sur le plan dentaire. 37,3% d’entre eux présentaient une parodontite modérée à sévère.
Après six mois, les participants ont été réévalués de manière identique.
Si la présence de parodontite n’était pas corrélée avec le score cognitif au début de l’étude (les patients avaient en moyenne le même score cognitif dans le groupe parodontite et dans le groupe sans parodontite), les patients du groupe parodontite étaient plus jeunes de 4,5 ans en moyenne. Le déclin cognitif frappe donc plus rapidement les patients atteints de parodontite.
Encore plus inquiétant, sur la brève durée de l’étude (6 mois), le déclin cognitif mesuré par le test « Alzheimer’s Disease Assessment Scale » a progressé six fois plus vite dans le groupe parodontite que dans le groupe des patients sains.
Si l’on peut regretter le faible nombre de participants à cette étude et le fait qu’elle relève seulement une association, on peut malgré tout en déduire que la parodontite a un effet négatif sur l’âge d’apparition et l’évolution de la maladie d’Alhzeimer.
- Yu YH, Kuo HK. Association between cognitive function and periodontal disease in older adults. J Am Geriatr Soc. 2008; 56(9):1693–7.
- Noble JM, Borrell LN, Papapanou PN, Elkind MS, Scarmeas N, Wright CB. Periodontitis is associated with cognitive impairment among older adults: analysis of NHANES-III. J Neurol Neurosurg Psychiatry. 2009; 80(11):1206–11.
- Stein PS, Desrosiers M, Donegan SJ, Yepes JF, Kryscio RJ. Tooth loss, dementia and neuropathology in the Nun study. J Am Dent Assoc. 2007; 138(10):1314–22. PMID: 17908844
- Ide M, Harris M, Stevens A, Sussams R, Hopkins V, Culliford D, et al. Periodontitis and Cognitive Decline in Alzheimer’s Disease. PLoS One. 2016; 11(3):e0151081.
- Martande SS, Pradeep AR, Singh SP, Kumari M, Suke DK, Raju AP, et al. Periodontal health condition in patients with Alzheimer’s disease. Am J Alzheimers Dis Other Demen. 2014; 29(6):498–502.
- Silver J.G., Martin A.W., McBride B.C. Experimental transient bacteraemias in human subjects with varying degrees of plaque accumulation and gingival inflammation. J Clin Periodontol. 1997;4:92–99.
- Ilievski V, Zuchowska PK, Green SJ, Toth PT, Ragozzino ME, Le K, et al. Chronic oral application of a periodontal pathogen results in brain inflammation, neurodegeneration and amyloid beta production in wild type mice. PLoS One. 2018;13(10):e0204941.
- A. L. Griffen, M. R. Becker, S. R. Lyons, M. L. Moeschberger, E. J. Leys, Prevalence ofPorphyromonas gingivalis and periodontal health status. J. Clin. Microbiol. 1998;36, 3239–3242.
- Dominy SS, Lynch C, Ermini F, et al. Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small‐molecule inhibitors. Sci Adv. 2019;5:eaau3333 10.1126/sciadv.aau3333
Commentaires récents